食品药品监督管理局官网网上申报
*** 次数:1999998 已用完,请联系开发者***
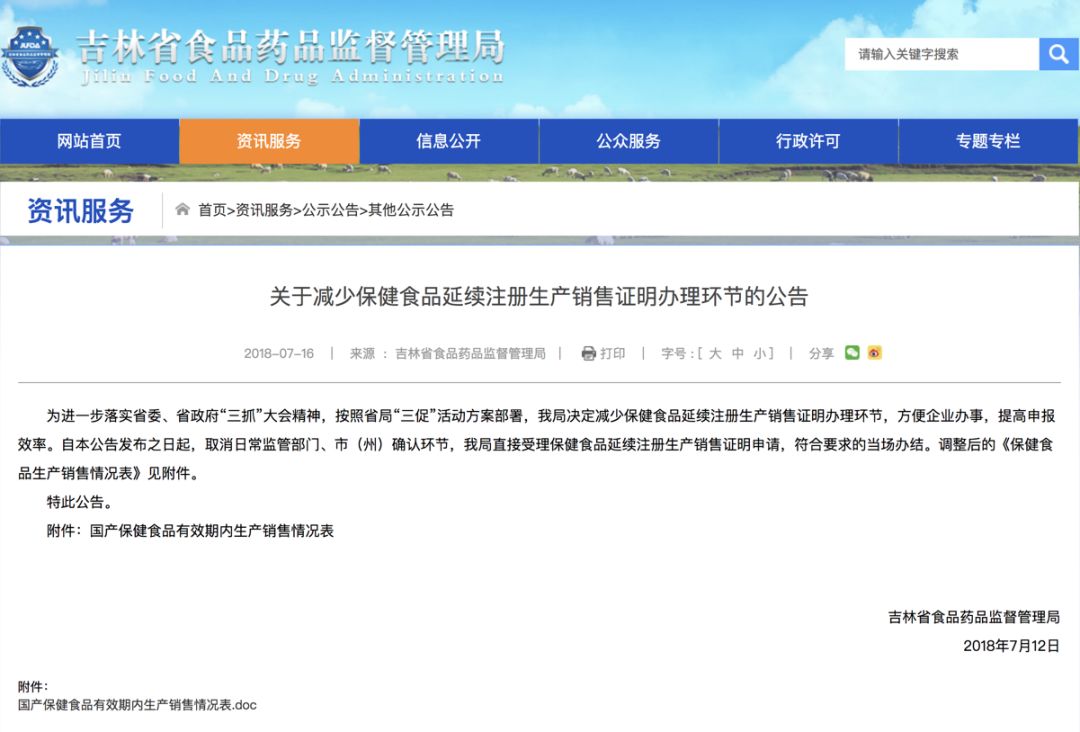
一周复盘 | 翰宇药业本周累计下跌15.39%,化学制药板块下跌3.28%公司已于12月23日收到美国食品药品监督管理局(以下简称“FDA”)的通知,由翰宇药业及Hikma联合向FDA申报的规格为18mg/3mL(6mg/mL)利拉鲁肽注射液新药简略申请(以下简称“ANDA”)已获得批准证书。公告指出,截至目前,公司与Hikma已签署累计合同金额为4640万美元(折合...
≥▽≤ 
华东医药:HDM1005注射液获美国FDA临床试验批准华东医药公告,全资子公司杭州中美华东制药有限公司申报的HDM1005注射液药品临床试验申请已获得美国食品药品监督管理局批准,可在美国开展I期临床试验。
(`▽′) 
⊙ω⊙ 6000万研发费用撬动近40亿大市场,恒瑞医药抢下全球首仿,获得半年...本文来源:时代财经 作者:李傲华 美国食品药品监督管理局(FDA)近日批准了恒瑞医药(600276.SH)申报的布比卡因脂质体注射液(商品名:艾恒平)的ANDA申请(简略新药申请,即美国仿制药申请),恒瑞医药成为首个在美国获得该品种仿制药批准的厂家。根据公告,布比卡因是一种用于局部麻...

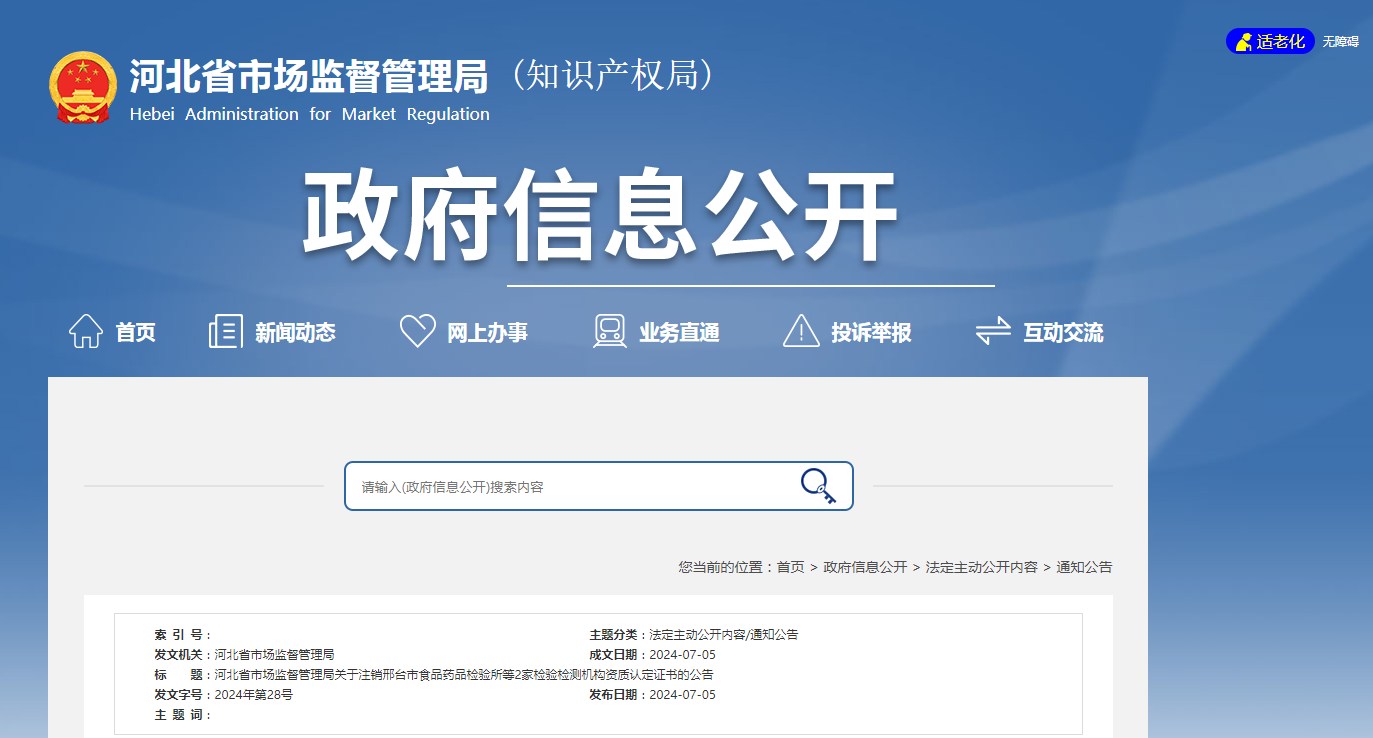
卡瑞利珠单抗联合疗法延迟在美上市 恒瑞医药:将尽快重新申报近日,恒瑞医药发布公告,该公司收到美国食品药品监督管理局(FDA)关于卡瑞利珠单抗联合阿帕替尼用于不可切除或转移性肝细胞癌患者一线治疗的生物制品许可申请(BLA)的完整回复信(Complete Response Letter )。回复信中,FDA表示会基于企业对生产场地检查缺陷的完整答复进行全...
⊙▽⊙ A股异动丨恒瑞医药午后一度涨超5.5%,布比卡因脂质体注射液已获...恒瑞医药(600276.SH)午后一度涨超5.5%,现涨3.66%报38.84元,总市值2478亿元。恒瑞医药昨日公告,近日,公司收到美国食品药品监督管理局通知,公司向美国FDA申报的布比卡因脂质体注射液ANDA已获得批准,是首家在美国获得该品种仿制药批准的厂家。布比卡因是临床上广泛用于局...

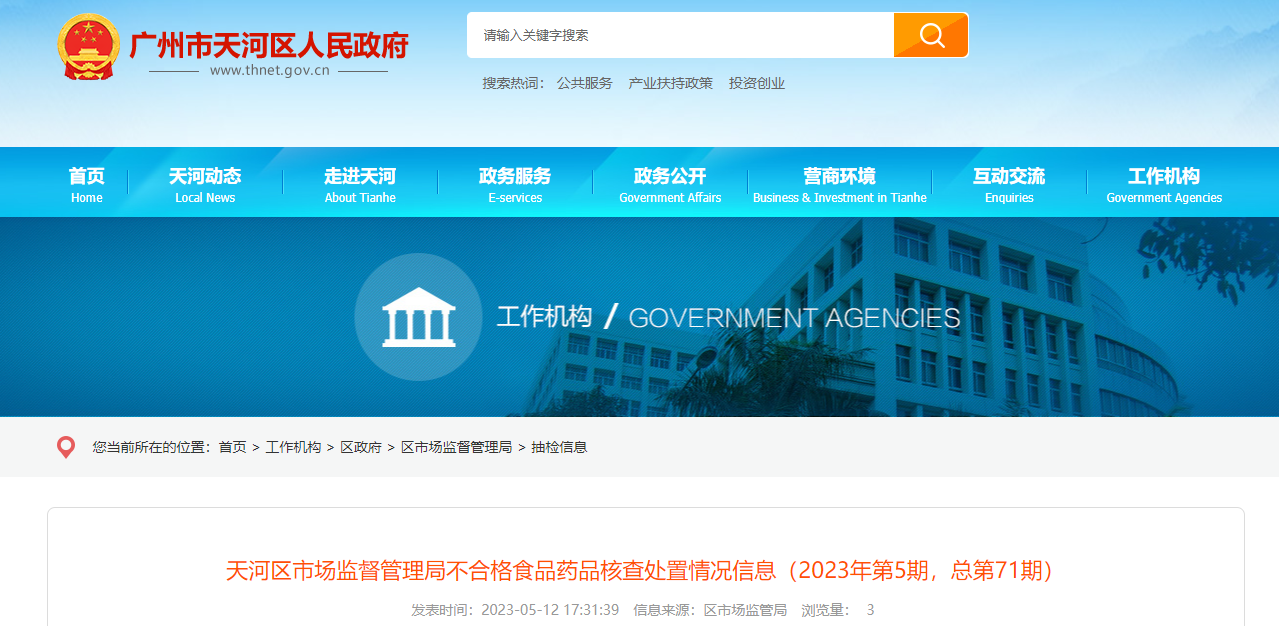
新诺威:控股子公司获美国FDA批准进行SYS6023药物临床试验金融界7月8日消息,新诺威控股子公司石药集团巨石生物制药有限公司近日获美国食品药品监督管理局(FDA)批准,其申报的注射用SYS6023药物临床试验申请已获批准,可以在美国开展临床试验。SYS6023是一款单克隆抗体药物偶联物,主要用于治疗晚期实体瘤。此前,SYS6023已于202...
ˋωˊ 
华东医药1类生物新药注射用HDM2005美国IND获FDA批准7月1日晚,华东医药股份有限公司宣布,公司全资子公司杭州中美华东制药有限公司收到美国食品药品监督管理局通知,由中美华东申报的注射用HDM2005药品临床试验申请已获得美国FDA批准,可在美国开展I期临床试验,适应症为晚期恶性肿瘤。本文源自金融界AI电报
普利制药:全资子公司安徽普利药业的钆特酸葡胺原料药收到FDA First ...金融界5月16日消息, 普利制药的全资子公司安徽普利药业近期收到美国食品药品监督管理局签发的钆特酸葡胺原料药 First Adequate Letter。这标志着原料药 US DMF 可满足关联制剂客户的申报要求,使得公司的产品因符合 FDA 要求而在市场竞争中更容易被新客户优先考虑,有利于寻...
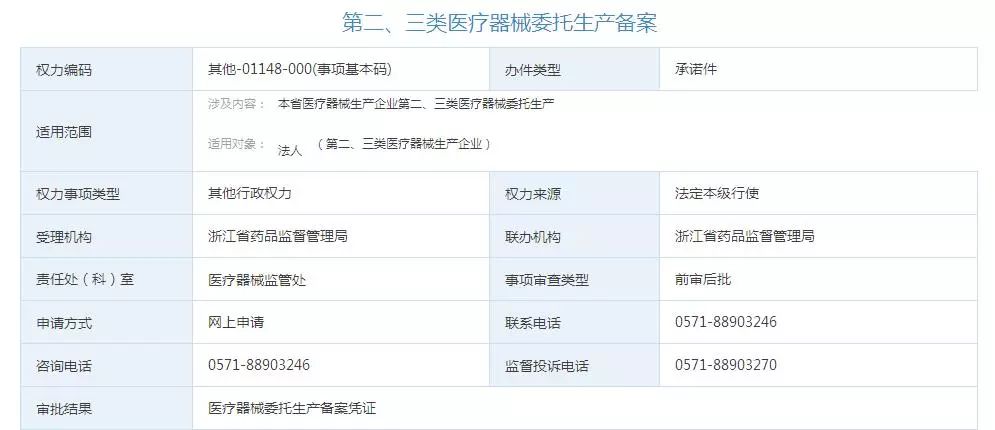
˙^˙ 苑东生物:盐酸尼卡地平注射液获得美国FDA药品注册批准苑东生物9月9日晚间公告,公司全资子公司成都硕德药业有限公司于近日收到美国食品药品监督管理局的通知,硕德药业向美国FDA申报的盐酸尼卡地平注射液的简化新药申请获得正式批准。盐酸尼卡地平注射液的主要成份为盐酸尼卡地平,适应症为用于无法口服给药时的高血压短期治疗...

华东医药:全资子公司药品磺达肝癸钠注射液获得美国FDA批准华东医药全资子公司杭州中美华东制药有限公司的申报药品磺达肝癸钠注射液已获得美国食品药品监督管理局(FDA)的批准。进一步丰富了华东医药心血管疾病领域的产品管线,并将为该产品拓展海外市场带来积极影响。据公告,公司在磺达肝癸钠注射液国际化项目的直接研发投入约为...
(^人^) 
i7加速器部分文章、数据、图片来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知删除。邮箱:xxxxxxx@qq.com
上一篇:食品药品监督管理局官网网址
下一篇:代替apkpure的应用





